Công thức chuyển đổi giữa lượng chất và khối lượng là Đầy đủ
Mẹo Hướng dẫn Công thức quy đổi giữa lượng chất và khối lượng là Chi Tiết
You đang tìm kiếm từ khóa Công thức quy đổi giữa lượng chất và khối lượng là được Cập Nhật vào lúc : 2022-04-10 20:26:10 . Với phương châm chia sẻ Kinh Nghiệm Hướng dẫn trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi Read nội dung bài viết vẫn ko hiểu thì hoàn toàn có thể lại Comments ở cuối bài để Admin lý giải và hướng dẫn lại nha.Chuyên đề Hóa học lớp 8: Chuyển đổi giữa khối lượng, thể tích và lượng chất được VnDoc sưu tầm và trình làng tới những bạn học viên cùng quý thầy cô tìm hiểu thêm. Nội dung tài liệu sẽ hỗ trợ những bạn học viên học tốt môn Hóa học lớp 8 hiệu suất cao hơn. Mời những bạn tìm hiểu thêm.
Nội dung chính- Chuyên đề: Chuyển đổi giữa khối lượng, thể tích và lượng chất
- A. Lý thuyết bài: Chuyển đổi giữa khối lượng, thể tích và lượng chất
- 1. Chuyển đối giữa lượng chất và khối lượng chất
- 2. Chuyển đổi giữa lượng chất và thể tích khí
- B.Trắc nghiệm bài: Chuyển đổi giữa khối lượng, thể tích và lượng chất
- C. Bài tập tự luyện
Chuyên đề: Chuyển đổi giữa khối lượng, thể tích và lượng chất
- A. Lý thuyết bài: Chuyển đổi giữa khối lượng, thể tích và lượng chất
- 1. Chuyển đối giữa lượng chất và khối lượng chất
- 2. Chuyển đổi giữa lượng chất và thể tích khí
- B.Trắc nghiệm bài: Chuyển đổi giữa khối lượng, thể tích và lượng chất
- C. Bài tập tự luyện
A. Lý thuyết bài: Chuyển đổi giữa khối lượng, thể tích và lượng chất
1. Chuyển đối giữa lượng chất và khối lượng chất
m = n x M (g) ⇒
2. Chuyển đổi giữa lượng chất và thể tích khí
V = 22,4 x n (l) ⇒ n = (mol)
B.Trắc nghiệm bài: Chuyển đổi giữa khối lượng, thể tích và lượng chất
Câu 1: Cho phương trình sau, tính khối lượng chất tạo thành biết 2,3 g Na
4Na + O2 → 2Na2O
A. 0,31 gB. 3 gC. 3,01 gD. 3,1 gCâu 2: Cho Fe + H2SO4 → FeSO4 + H2. Tính VH2 biết mFe = 15,12 g
A. 6,048 lB. 8,604 lC. 5,122 lD. 2,45 lCâu 3: Chọn đáp án đúng: Số mol của 12g O2, 1,2 g H2, 14 g N2
A. 0,375 mol; 0,6 mol; 0,5 mol
B. 0,375 mol; 0,5 mol; 0,1 mol
C. 0,1 mol; 0,6 mol; 0,5 mol
D. O,5 mol; 0,375 mol; 0,3 mol
Câu 4: Thể tích của CH4 ở đktc lúc biết m = 96 g
A. 134,4 mlB. 0,1344 mlC. 13,44 mlD. 1,344 mlCâu 5: Số mol nguyên tử C trong 44 g CO2
A. 2 molB. 1 molC. 0,5 molD. 1,5 molCâu 6: Nếu 2 chất rất khác nhau nhưng có ở cùng nhiệt độ và áp suất, hoàn toàn có thể tích bằng nhau thì
A. Cùng khối lượng
B. Cùng số mol
C. Cùng tính chất hóa học
D. Cùng tính chất vật lí
Câu 7: Cho mCa = 5 g, mCaO = 5,6 g. Kết luận đúng
A. nCa > nCaO
B. nCa < nCaO
C. nCa = nCaO
D. VCa = VCaO
Câu 8: Cho nN2 = 0,9 mol và mFe = 50,4 g. Kết luận đúng
A. Cùng khối lượng
B. Cùng thể tích
C. Cùng số mol
D.mFe < mN2
Câu 9: Phải cần bao nhiêu mol nguyên tử C để sở hữu 2,4.1023 nguyên tử C
A. 0,5 molB. 0,55 molC. 0,4 molD. 0,45 molCâu 10: Số mol của 19,6 g H2SO4
A. 0,2 molB. 0,1 molC. 0,12 molD. 0,21 molCâu 11. Thể tích của CH4 ở đktc lúc biết m = 96 g
A. 134,4 ml
B. 0,1344 ml
C. 13,44 ml
D. 1,344 ml
Câu 12.Số mol nguyên tử C trong 44 gam CO2
A. 2 mol
B. 1 mol
C. 0,5 mol
D. 1,5 mol
Câu 13.Phát biểu nào sau này là đúng thời cơ nói về khái niệm khối lượng mol?
A. Khối lượng mol một chất khác tri số với nguyên tử khối, phân tử khối của chất đó.
B. Khối lượng mol một chất là khối lượng tính bằng gam 1 mol chất đó.
C. Khối lượng mol của phân tử amoniac là 14
D. Khối lượng mol của axit clohidric là 35,5
Câu 14. Phát biểu nào sau này không đúng thời cơ nói về khái niệm thể tích mol?
A. Thể tích mol của chất khí là thể tích được chiếm bởi N nguyên tử/phân tử chất đó.
B. Ở Đk tiêu chuẩn, 0,5 mol chất khí chiếm thể tích là 11,2 lít .
C. Ở cùng Đk nhiệt độ, áp suất, thể tích mol của những chất khí rất khác nhau là bằng nhau.
D. Thể tích mol chiếm bởi 1 mol chất khí ở 0oC, 1atm là 22,4 lít.
Câu 15.Số phân tử P2O5 xuất hiện trong 0,5 mol P2O5 là
A. 3.1023 phân tử
B. 6.1023 phân tử
C. 1,5.1024 phân tử
D. 3,5.1024 phân từ
1. Đáp án vướng mắc trắc nghiệm
1.D2.A3.A4.B5.B6.B7.A8.C9.C10.A11. A12. B13. B14. D15. A2. Hướng dẫn giải bài tập
Câu 1: nNa = 2,3/23 = 0,1 mol
4Na + O2 → 2Na2O
0,1→ 0,05 mol
mNa2O = 0,05.(23.2+16) = 3,1 g
Câu 2: nFe = 15,12/56 = 0,27 mol
Nhìn vào phương trình thấy nFe = nH2 = 0,27 (l)
⇒ VH2 = 22,4.0,27 = 6,048 l
Câu 4: n = 96/16 = 6 mol
V = 22,4.6 = 134,4 (l) = 0,1344 (ml)
Câu 5: nCO2 = 44/44 = 1 mol
Trong phân tử CO2 có một nguyên tử C nên nC= 1 mol
Câu 7: nCa = 5/20 = 0,25 mol & nCaO = 5,6/56 = 0,1(mol)
0,25 > 0,1 ⇒ nCa > nCaO
Câu 8: nFe = 50,44/56 = 0,9 mol = nN2
Câu 9: n = 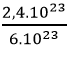 = 0,4 mol
= 0,4 mol
Câu 10: n = 19,6/98 = 0,2 mol
Với chuyên đề: Chuyển đổi giữa khối lượng, thể tích và lượng chất trên đây toàn bộ chúng ta hoàn toàn có thể làm rõ về khái niệm, tính chất, công thức quy đổi Một trong những cty tính.
Câu 11.
Số mol của khí CH4 là
nCH4 = 96 : 16 = 6 mol
VCH4 = 22,4 .6 = 134,4 lít
C. Bài tập tự luyện
Câu 1. Tính số mol nguyên tử hoặc phân tử trong những lượng chất sau:
a) 1,44.1023 phân tử HCl
b) 24.1023 nguyên tử Na
Câu 2. Tính khối lượng của những lượng chất sau:
a) 0,3 mol nguyên tử Na; 0,3 mol phân tử O2
b) 1,2 mol phân tử HNO3; 0,5 mol phân tử Cu
c) 0,125 mol của mỗi chất sau: KNO3, KMnO4, KClO3
Đáp án hướng dẫn giải
Áp dụng công thức tính khối lượng:
a) Khối lượng của 0,3 mol nguyên tử Na bằng: mNa = nNa.MNa = 0,3.23 = 6,9 gam
Khối lượng của 0,3 mol phân tử O2 bằng: mO2 = nO2. MO2= 0,3.32 = 9,6 gam
b) Khối lượng 1,2 mol phân tử HNO3 bằng: mHNO3 = nHNO3.MHNO3 = 1,2 . 63 = 75,6 gam
Khối lượng 0,5 mol phân tử Cu bằng: mCu = nCu.MCu = 0,5.64 = 32 gam
c) Khối lượng 0,125 mol phân tử KNO3 bằng: mKNO3 = nKNO3.MKNO3 = 0,125. 101 = 12,625 gam
Khối lượng 0,125 mol phân tử KMnO4 bằng:
mKMnO4 = nKMnO4.MKMnO4 = 0,125.158 = 19,75 gam
Câu 3. Tính số mol của những lượng chất sau:
a) 4,6 gam Na; 8,4 gam KOH; 11,76 gam H3PO4; 16 gam Fe2O3
b) 2,24 lít khí C2H4; 3,36 lít khí CO2, 10,08 lít khí N2. Các thể tích đo ở đktc.
Câu 4. Tính khối lượng (gam) của những lượng chất sau:
a) 6,72 lít khí SO2; 1,344 lít khí Cl2. Các thể tích khí được đo ở đktc.
b) 0,32 mol Na2O; 1,44 mol CaCO3
Câu 5.
a) Phải lấy bao nhiêu gam KOH để đã có được số phân tử bằng số nguyên tử có trong 4,8 gam Magie?
b) Phải lấy bao nhiêu gam NaCl để sở hữu số phân tử bằng số phân tử có trong 3,36 lít khí CO2 (đktc)?
.........................................
VnDoc trình làng tới những bạn Chuyển đổi giữa khối lượng thể tích và lượng chấtđược VnDoc biên soạn. Ở bài 19 hóa 8 này những bạn phải nắm được công thức tính số mol, tính khối lượng từ đó quy đổi giữa khối lượng thể tích và lượng chất, vận dụng làm những dạng bài tập.
Mời những bạn tìm hiểu thêm một số trong những tài liệu liên quan:
- Hóa học 8 Bài 20: Tỉ khối của chất khí
- Giải bài tập SBT Hóa học lớp 8 bài 19: Chuyển đổi giữa khối lượng, thể tích và lượng chất
- Trắc nghiệm Hóa học 8 bài 19
Để có kết quả cao hơn trong học tập, VnDoc xin trình làng tới những bạn học viên tài liệu Chuyên đề Toán 8, Chuyên đề Vật Lý 8, Chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã xây dựng group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 8. Mời những bạn học viên tham gia nhóm, để hoàn toàn có thể nhận được những tài liệu tiên tiến và phát triển nhất.
Chuyển đổi giữa khối lượng thể tích và lượng chất. Lý thuyết Chuyển đổi giữa khối lượng thể tích và lượng chất.. Công thức quy đổi giữa lượng chất
I. Lý thuyết cần nhớ:
1. Công thức quy đổi giữa lượng chất (n) và khối lượng chất (m):
n = (fracmM) (mol)
(M là khối lượng mol của chất)
Quảng cáo2. Công thức quy đổi giữa lượng chất (n) và thể tích của chất khí (V) ở Đk tiêu chuẩn
n = (fracV22,4) (mol)
Share Link Download Công thức quy đổi giữa lượng chất và khối lượng là miễn phí
Bạn vừa đọc tài liệu Với Một số hướng dẫn một cách rõ ràng hơn về Video Công thức quy đổi giữa lượng chất và khối lượng là tiên tiến và phát triển nhất và ShareLink Download Công thức quy đổi giữa lượng chất và khối lượng là Free.
